发布时间:2019-01-10
美国FDA对生物类似药的定义是:与已批准的参比制剂高度相似的(highlysimilar)、没有临床意义上的差异的生物制品。
2016年全球生物类似药市场规模约为16亿美元,而随着部分重磅生物原研药的专利陆续到期,生物类似药市场规模随着获批上市品种数量的持续增加也将迎来日益繁荣。据Evaluate预测,2022年全球生物类似药市场规模将达到90亿美元(约合615亿元人民币),是2016年的5.6倍,年均复合增长率更是将达到33%左右,远远超过生物药市场。
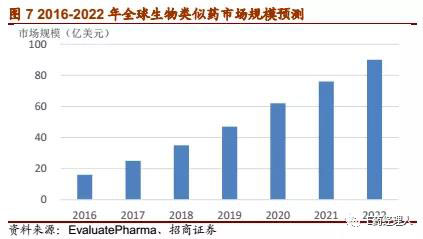
而且与生物药相仿,生物类似药的研发同样如火如荼且竞争更为激烈。截止2017年底,全球处于申请上市和临床III期的生物类似药分别有18个和66个,处于临床前阶段的生物类似药更是达到了176个,而中止研发的生物类似药则高达290个。
按照国际标准,中国目前还没有第一款正式上市的生物类似药,这与我国在生物类似药监管上近年才开始与国际接轨有密切关系。
但处于上市申请阶段的品种有4个、临床Ⅲ期的品种则高达20个。预计国内第一款生物类似药有望于2019年初获批上市,而未来5年每年都将有5-10款产品陆续上市,主要覆盖抗TNF-α抗体和肿瘤单抗领域。
而且随着国家监管趋严,并在 2015 年之后与国际接轨陆续出台了关于生物类似药的相关监管细则,预计背靠庞大市场的中国生物类似药不仅将在短期内迎来第一款产品正式上市,同时也将步入行业发展的春天,竞争也将较其他国家更为激烈。未来我国哪家企业能在生物类似药市场竞争中杀出重围,确立领先地位,值得期待。
1、中国生物类似药监管由松到紧
中国对于生物类似药的经历了监管由松到紧、认识由低到高的三个阶段。第一个阶段是上世纪九十年代至2007年《药品注册管理办法》正式出台,此时国内对于生物类似药还没有形成一定明确的认知,对国内药企申报的胰岛素、G-CSF和干扰素等本质上的生物类似药产品在审批上持较为宽松的态度,造成这个阶段相关产品的批文一度泛滥,市场竞争十分激烈。
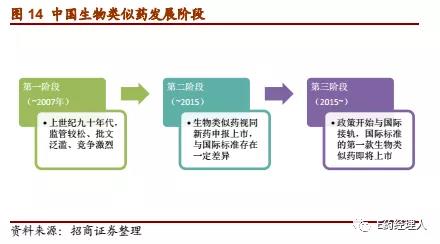
随着2007年《药品注册管理办法》颁布并规定所有生物制品必须按照新药上市流程进行申报,而生物类似药也不例外,国内生物类似药发展进入第二阶段。此时,虽然有一些国内药企自主研发的生物类似药在国内上市,比如三生国健的益赛普、赛金生物的强克以及海正药业的安佰诺(皆为依那西普生物类似药),但因为结构上的差异和并没有经过头对头临床试验的对比验证,严格意义上这些产品并不被国际上视作生物类似药。
到了2015年,当生物类似药上市热潮开始席卷欧美日等发达国家,我国生物类似药发展终于进入了与国际接轨的第三阶段。
首先是同年CFDA药品审批中心(CDE)颁布了《生物类似药研发与评价技术指导原则(试行)》,对生物类似药的申报程序、注册类别和申报资料等相关注册要求进行了规范;而2016年《药品注册管理办法(修订稿)》也正式提出,重点关注生物类似药与生物原研药质量和疗效的类似;此后2017年《生物制品通用名命名原则规程》(征求意见稿)发布,进一步为生物类似药向国际化接轨铺平了道路。在政策的鼓励和拉动下,中国生物类似药行业将迎来发展的春天。
2、胰岛素先行一步
值得一提的是,目前国内的第三代胰岛素市场已经进入了实质上的生物类似药时代,甘李药业的2005年推出的重组甘精胰岛素是第一个在国内上市的国产第三代胰岛素,与原研厂商赛诺菲的重组甘精胰岛素和礼来的重组门冬胰岛素展开了激烈的竞争,并取得了不小的市场份额。
2014-2016年,甘李药业重组甘精胰岛素实现销售收入7.83亿元、11.39亿元和16.32亿元,年均复合增长率达到44.34%,同时在国内胰岛素市场的占比也由10.71%提高到了16.19%。
国内胰岛素市场先行一步实现了生物类似药的原研替代,而随着联邦制药和通化东宝等国内厂商的第三代胰岛素已经或即将陆续上市销售,国内胰岛素市场的生物类似药之争将更加激烈。
3、复宏汉霖或将拔得头筹
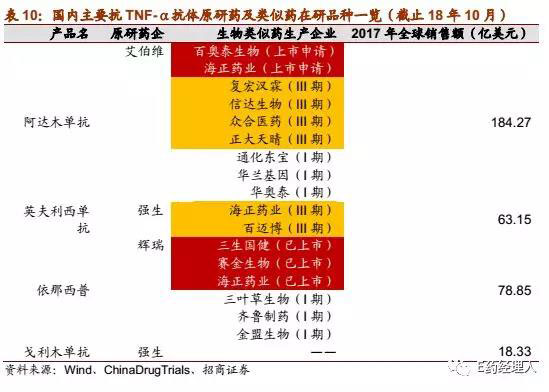
根据国内对抗TNF-α抗体和肿瘤单抗为主的生物类似药研发竞争格局进行梳理,截至2018年10月,除开早年已经先期上市的3个抗TNF-α抗体产品,国内目前提出上市申请的生物类似药有4个,处于临床III期的品种有20个,而处于临床I/II期阶段的品种有17个。
公司方面,在国内涉足生物类似药领域的药企中,上市公司及其子公司独占鳌头,海正药业、复宏汉霖、正大天晴和信达生物是其中的佼佼者,而百奥泰生物和嘉和生物等一众国内生物药创新研发企业也不容小觑。
另外在国内肿瘤单抗市场方面,由于与抗TNF-α抗体市场不同,目前还是原研药的天下,生物类似药上市后将面临激烈的正面交锋。
以利妥昔单抗、曲妥珠单抗和贝伐单抗为代表的肿瘤单抗原研药在临床和患者中都具有较高的认知度,且皆被纳入第二批医保谈判目录,大幅降价后年治疗费用在10万元左右,生物类似药的价格竞争空间受到一定限制。
国内主要肿瘤单抗生物类似药的竞争格局较为均衡,利妥昔单抗、曲妥珠单抗和贝伐单抗分别有11家、7家和9家企业参与了生物类似药的研发,其中利妥昔单抗的进度较快,已经有1个品种提出上市申请,另有4个品种位于临床III期;贝伐单抗的竞争格局不输前者,位于临床III期以后阶段的品种数量也达到了7个;而曲妥珠单抗目前有4个品种处于临床III期。毫无疑问,国内第一个肿瘤单抗的生物类似药将会出自于利妥昔单抗,复宏汉霖的上市申请在2018年年初已被纳入优先审评序列,有望拔得头筹。
不过根据国内生物类似药研发进展的竞争激烈程度,肿瘤单抗虽然空间较大,但生物类似药的市场竞争或将更为惨烈,“赛道经济”效应也将会极为明显,所以布局最广、有望最早有品种上市的复宏汉霖可能成为最大受益者。

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床