发布时间:2022-07-11
看点:
2022年上半年药审中心受理总量为5850个(不计复审)
2022年上半年7个化药1类创新药获批上市,4个生物制品1类创新药获批上市
2022年上半年426个按仿制药质量和疗效一致性评价申报获受理
2022年上半年22个品种纳入优先审评程序,22个品种纳入突破性治疗审评程序
随着《药品注册管理办法》的颁布实施,药品审评体系的改革和审评能力的现代化,在“创新”政策引领下,整体申报格局从过去以仿制药申报为主正逐渐被创新药替代。那2022年上半年注册申报情况如何呢?以下且看2022年上半年化药、中药、生物制品的注册受理及审评情况详细分析。
2022年上半年药品申请受理情况
2022年上半年申报整体情况
1.2022年上半年受理情况
根据药智数据最新统计,2022年1-6月份CDE共承办新的药品注册申请有5850个(以受理号计,复审除外,下同)其中化药受理4139个,中药受理740个,生物制品受理961个;2022年1-6月药品注册申请受理情况详见图1。
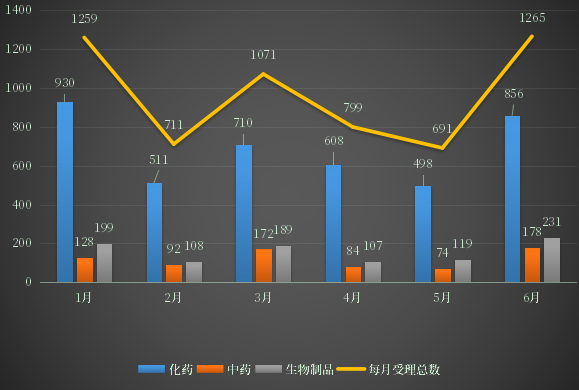
图1 2022年1-6月CDE药品受理情况
数据来源:药智数据、药智咨询整理
2.2022年上半年各注册申请类型申报情况
2022年上半年CDE受理申请以注册申请类别统计,受理新药临床试验申请(以下简称IND)受理号1058个;新药上市许可申请(以下简称NDA)受理号168个;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)受理号1077个;仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)受理号426个;2022年1-6月各申请类别注册申请受理量详见图2。
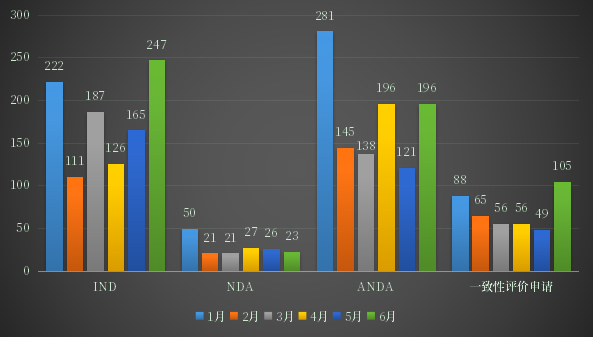
图2 2022年1-6月各申请类别注册申请受理量
数据来源:药智数据、药智咨询整理
3.2022年上半年创新药注册申请受理情况
2022年上半年CDE受理1类创新药申请832个,涉及抗肿瘤、抗感染等多领域;其中,化药申请494个,中药申请23个,生物制品申请315个;2022年1-6月1类创新药申请受理情况详见图3。
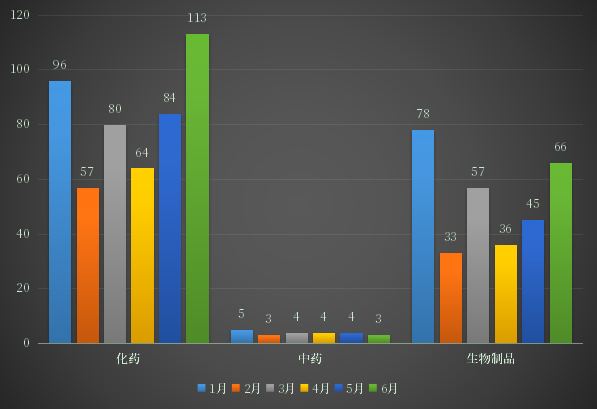
图3 2022年1-6月1类创新药申请受理情况
数据来源:药智数据、药智咨询整理
2022年上半年化药申报情况
1.2022年上半年化药受理情况
2022年上半年CDE共受理化学药注册申请受理号4139个,以申请类型计,新药申请495个,进口申请404个,仿制申请1052个,进口再注册171个,补充申请2014个。以审评任务类别统计,IND申请633个,ANDA申请1077个,NDA申请90个,一致性评价申请426个;2022年上半年化学药各审评任务类别申请受理情况详见图4。
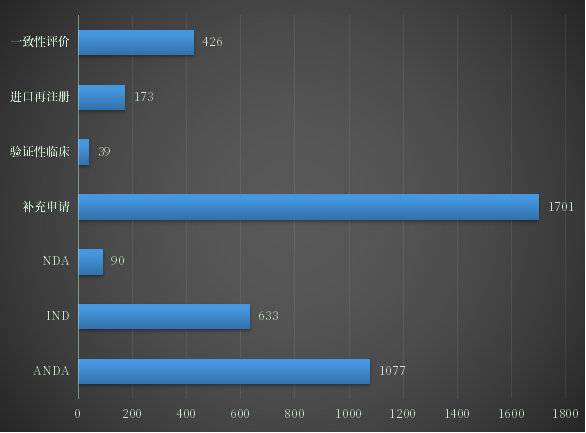
图4 2022年上半年化学药各审评任务类别申请受理情况
数据来源:药智数据、药智咨询整理
2.2022年上半年化药1类创新药申报情况
2022年上半年CDE受理化学药1类创新药受理号494个,其中国产375个,进口119个;以审评任务类别统计,IND申请478个,涉及品种227个,NDA申请16个,涉及品种8个;2022年1-6月化药1类创新药注册申请受理情况详见图5。
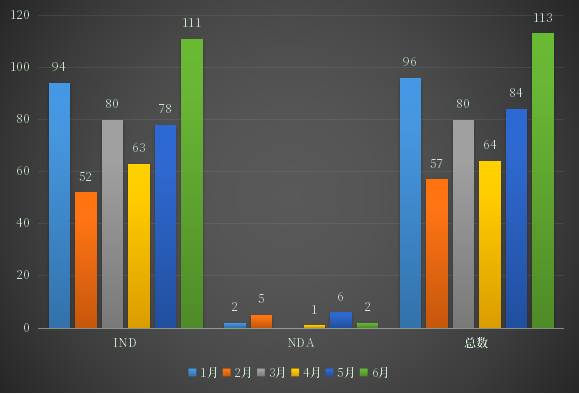
图5 2022年1-6月化药1类创新药注册申请受理情况
数据来源:药智数据、药智咨询整理
3.2022年上半年化药改良型新药申报情况
按照现行化学药品注册分类,2类是指“境内外均未上市的改良型新药,指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品”,即我们常说的改良型新药。
在2022年上半年CDE新受理化药2类改良型新药受理号164个,其中,IND申请136个,NDA申请28个;2022年1-6月化药2类改良型新药注册申请受理情况详见图6。
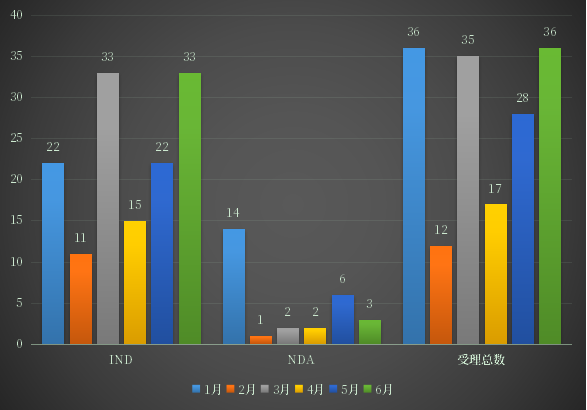
图6 2022年1-6月化药2类改良型新药注册申请受理情况
数据来源:药智数据、药智咨询整理
4.2022年上半年化药一致性评价申报情况
在2022年上半年CDE新受理的一致性评价受理号426个,涉及品种198个,企业216家,其中以山东鲁抗医药申请最多,其次是成都倍特与华北制药;2022年上半年企业一致性评价申请数TOP10详见图7。
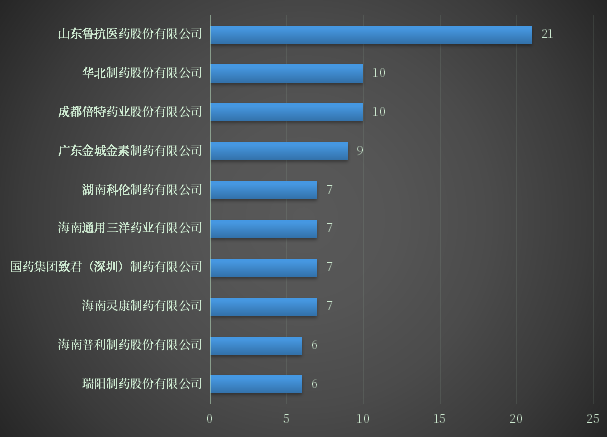
图7 2022年上半年企业一致性评价申请数TOP10
数据来源:药智数据、药智咨询整理
2022年上半年中药申报情况
1.2022年上半年中药受理情况
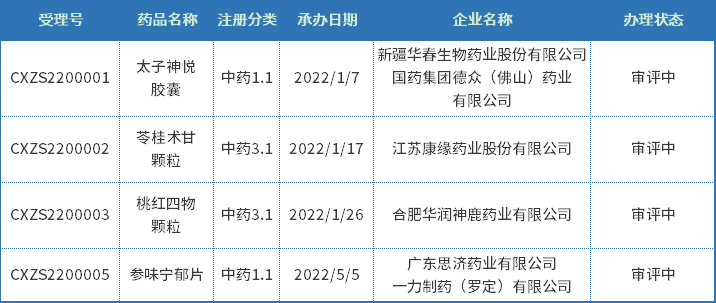
中药受自身药品特性的影响,一直以来申报都处于比较低迷的状态,在2022年上半年CDE共承办新的中药注册申请有740个;以审评任务类别统计,IND申请31个,NDA申请4个;2022年上半年新承办的中药上市申请见表一。
表一 2022年上半年新承办的中药上市申请
2022年上半年生物制品申报情况
1.2022年上半年生物制品受理情况
2022年上半年CDE受理生物制品注册申请961个,其中,新药申请349个,补充申请411个,进口171个(其中包括一次性进口7个),进口再注册30个;2022年上半年生物制品注册申请受理情况详见图8。
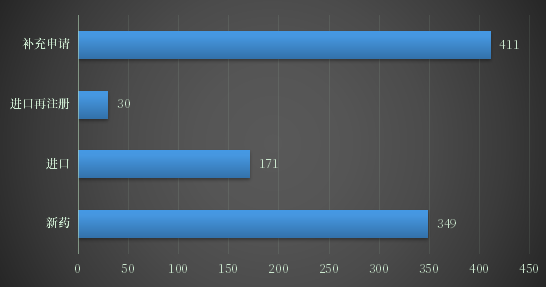
图8 2022年上半年生物制品注册申请受理
数据来源:药智数据、药智咨询整理
2.2022年上半年生物制品创新药申报情况
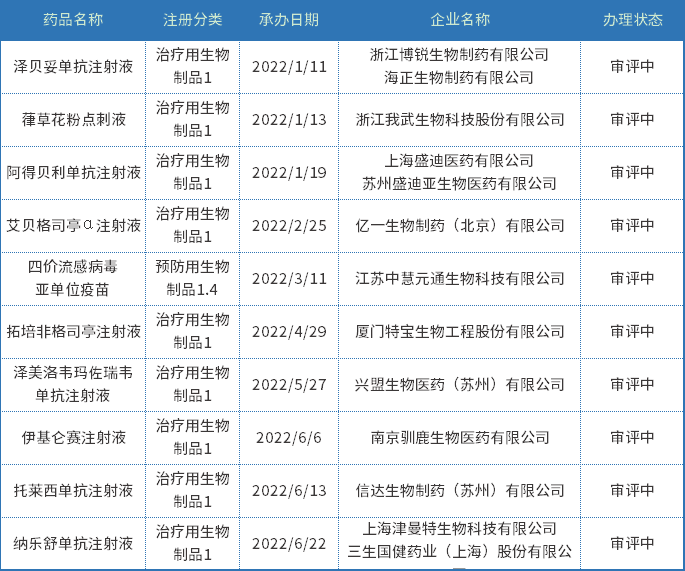
2022年上半年受理生物制品1类创新药315个;以审评任务类别统计,IND申请301个(其中预防用生物制品3个,治疗用生物制品298个),NDA申请14个(其中预防用生物制品1个,治疗用生物制品13个);2022年上半年新承办生物制品1类新药上市申请见表二。
表二 2022年上半年新承办生物制品1类新药上市申请
2022年上半年药品注册审评完结情况
2022年上半年审评完结整体情况
根据药智注册与受理数据库最新统计,2022年上半年(注:状态开始时间(药智)从2022年1月1日至2022年06月30日)审评完结受理号数量为5338个,药智收录到结论的数量为5334个受理号,其中化药3760个,中药673个,生物制品882个。2022年上半年注册申请审评完结结论详情统计见图9。
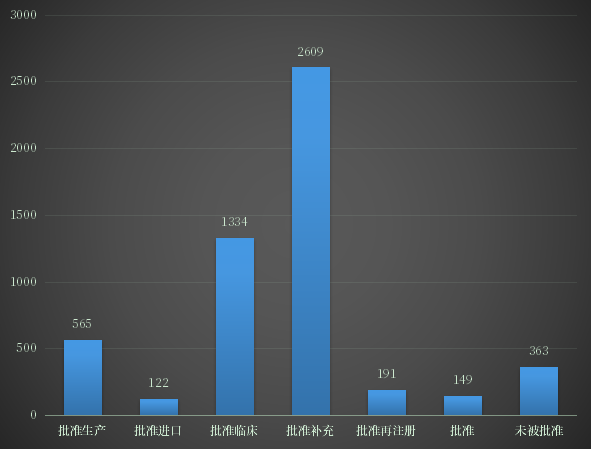
图9 2022年上半年注册申请审评完结结论详情
数据来源:药智数据、药智咨询整理
2022年上半年化药创新药批准情况
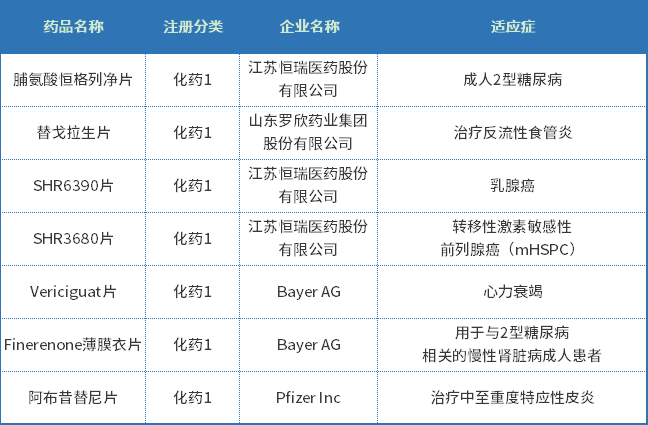
2022年上半年CDE共审评完结化药1类创新药受理号481个;其中IND申请464个,全部批准临床,涉及抗肿瘤、内分泌系统和抗感染等多个领域;NDA申请17个,15个批准上市,涉及糖尿病、乳腺癌、皮炎等适应症;2022年上半年新批准上市1类化药创新药见表三。
表三 2022年上半年新批准上市1类化药创新药
2022年上半年生物制品创新药批准情况
2022年上半年CDE共审评完结化药1类创新药受理号277个;其中IND申请273个,全部批准临床,涉及晚期实体瘤、非小细胞肺癌和三阴性乳腺癌等适应症;NDA申请4个,全部获批上市;2022年上半年新批准上市1类生物制品创新药见表四。
表四 2022年上半年新批准上市1类生物制品创新药

2022年上半年药品加快上市注册程序审评情况
2022年上半年优先审评情况
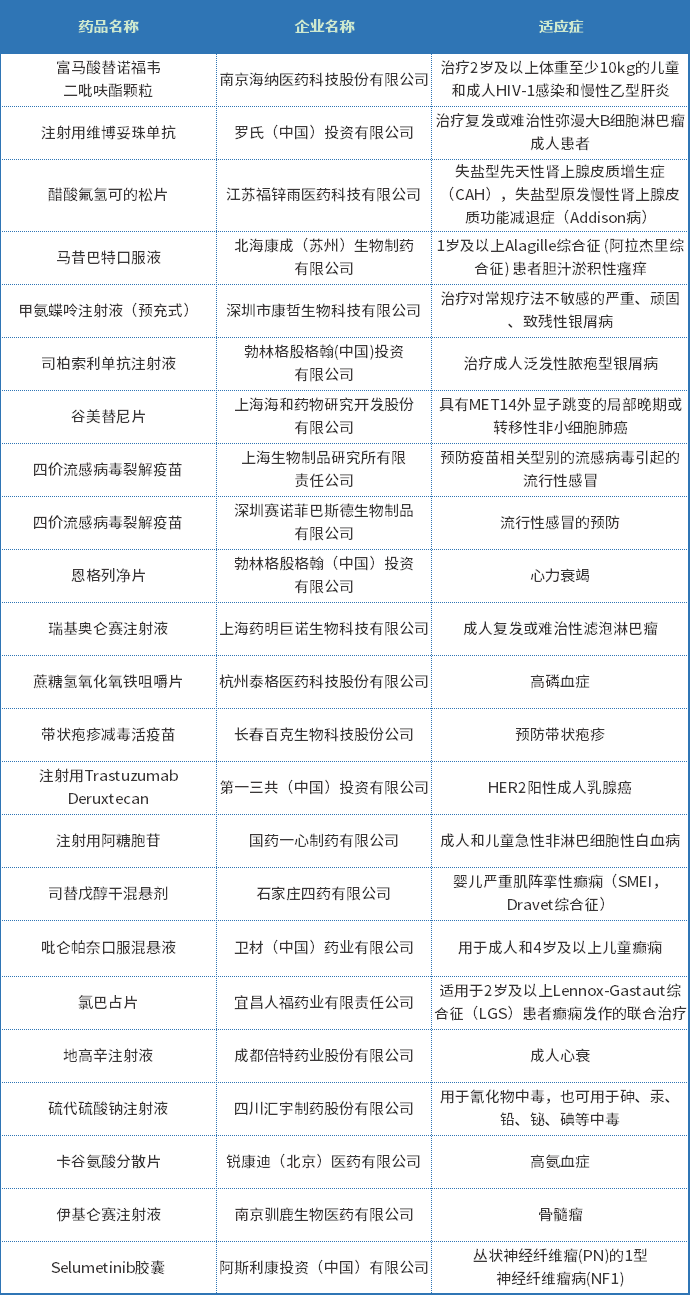
2022年上半年有22个品种纳入优先审评程序,其中化药15个,生物制品7个纳入理由包含符合附条件批准、儿童用药等;适应症包括癫痫、银屑病和高磷血症等适应症;2022年上半年纳入优先审评审批程序品种见表五。
表五 2022年上半年纳入优先审评审批程序品种
2022年上半年突破性治疗审评情况
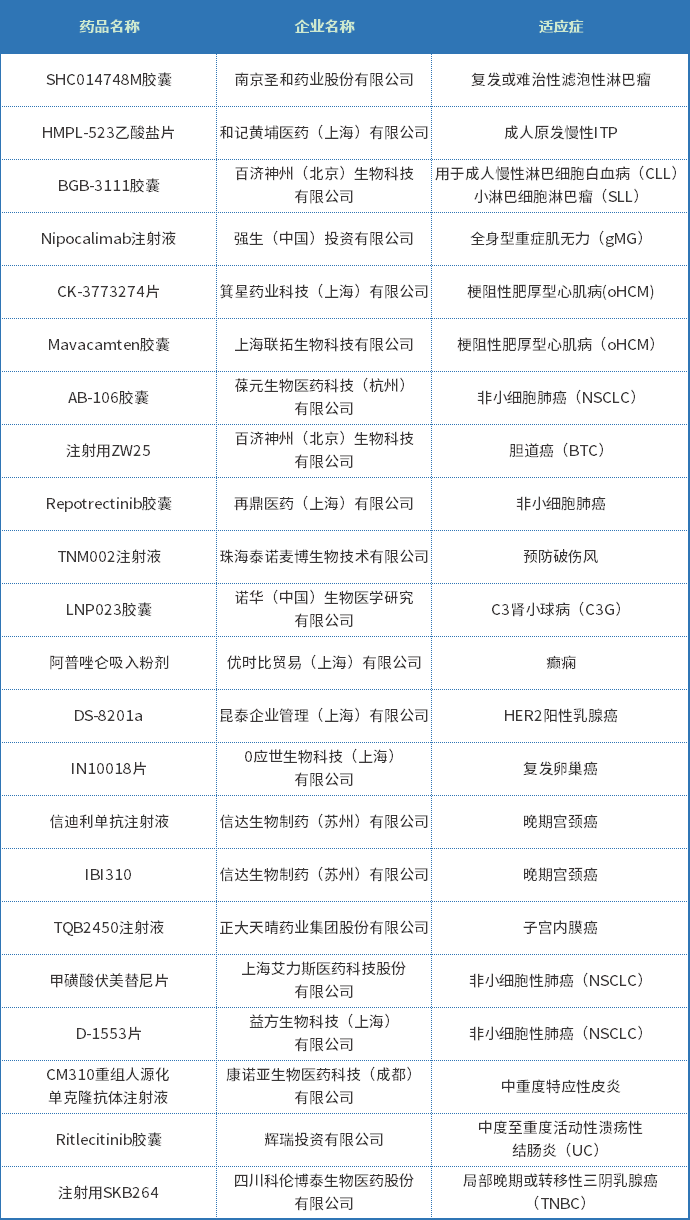
2022年上半年有22个品种纳入突破性治疗审评程序,其中化药13个,生物制品9个;适应症包括癫痫、非小细胞性肺癌和全身型重症肌无力等适应症;2022年上半年纳入突破性治疗审评程序品种见表六。
表六 2022年上半年纳入突破性治疗审评程序品种
数据来源:药智药品注册与受理数据库

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床