发布时间:2022-04-11
看点
1、信达生物第7款产品获批上市!
2、重磅丙肝药「达拉他韦」迎来首仿
3、首款国产带状疱疹疫苗申报上市
4、新型帕金森、偏头痛新药申报进口
本期(4月1日至4月8日),多款重磅新药申报进口,信达生物拿下第7款产品,首款国产带状疱疹疫苗报产,更多动态如下:
国内审评审批·新动态
本期CDE有52个受理号(35个品种)报生产办理状态更新,其中信达生物的佩米替尼片和南京圣和药业的盐酸达拉他韦片备受关注。更多动态如下:
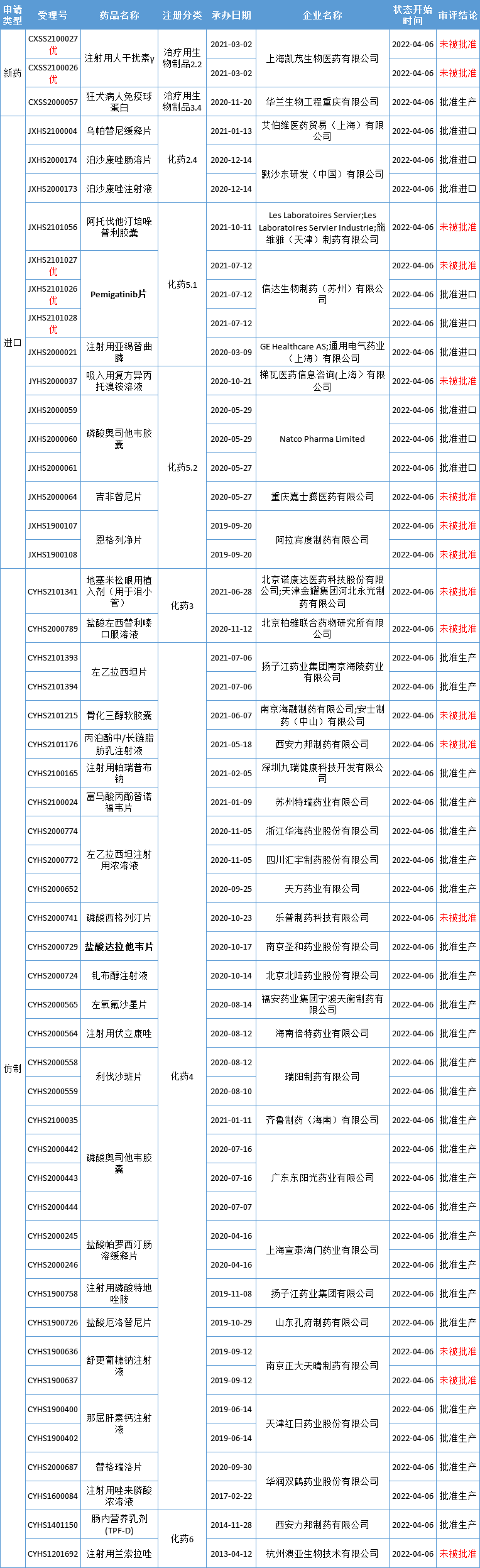
数据来源:药智数据
信达生物第7款产品获批上市!
4月6日,信达生物申报的佩米替尼片(pemigatinib,商品名:达伯坦)获国家药监局批准上市,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。
Pemigatinib是由 Incyte 公司开发的一种针对FGFR亚型1/2/3的强效选择性口服抑制剂,于 2020 年 4 月首次在美国获批上市,商品名为 Pemazyre?。 2018 年,信达生物与 Incyte 达成战略合作,获得了该公司包括 Pemigatinib 在内的 3 款药物在中国内地及港澳台地区的临床开发和商业化权益。此前pemigatinib已在中国台湾、中国香港相继获批。
此次Pemigatinib获NMPA批准,成为首个在中国获批的选择性FGFR受体酪氨酸激酶抑制剂,也是信达生物获批上市的第7款产品。此前信达生物已获批的产品分别是:信迪利单抗注射液,贝伐珠单抗生物类似药、阿达木单抗生物类似药、利妥昔单抗生物类似药、奥雷巴替尼片、雷莫西尤单抗。
重磅丙肝药「达拉他韦」迎来首仿
本周,南京圣和药业的丙肝病毒口服治疗药物盐酸达拉他韦片获批上市,成为该药国内首仿。另外,扬子江药业申报的盐酸达拉他韦片未获NMPA批准。
达拉他韦原研为百时美施贵宝(BMS),是第一个抗丙肝病毒的NS5A抑制剂。该药于2014、2015年先后在日本、欧洲和美国获批用于治疗丙肝病毒感染,2017年首次在中国获批上市,这也是在我国首次上市的丙型肝炎直接抗病毒药。
国内审评审批·新受理
本期CDE新增报生产受理号32个,共23个品种,其中百克生物的带状疱疹减毒活疫苗、Zambon公司的沙芬酰胺片,以及诺华的Erenumab注射液备受关注,更多动态见下表:
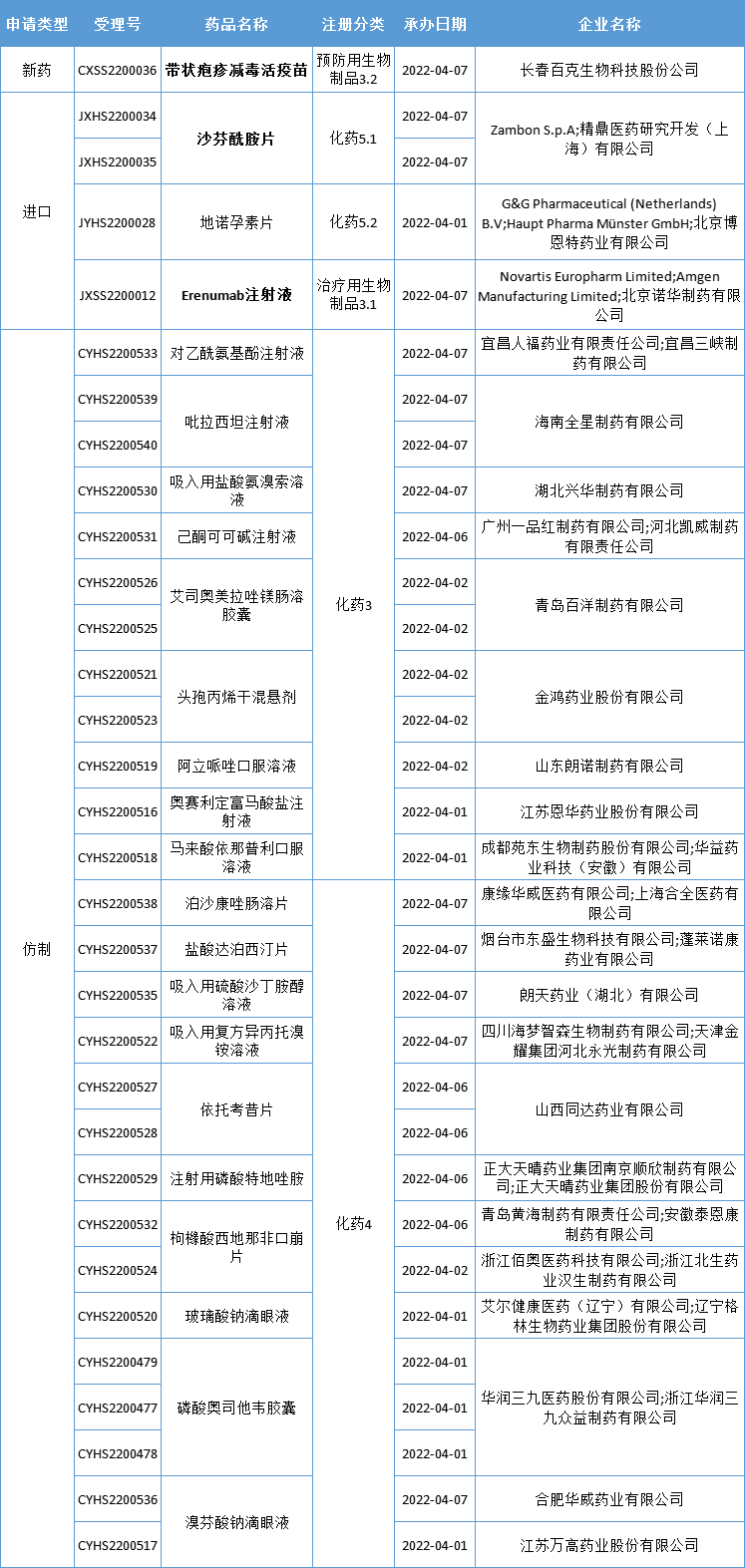
数据来源:药智数据
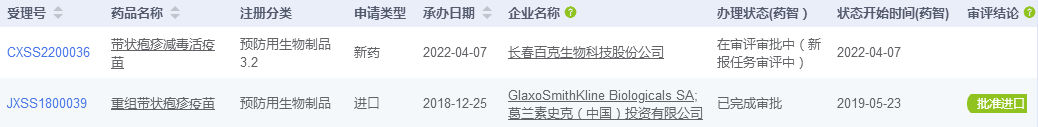
首款国产带状疱疹疫苗申报上市
药智数据显示,长春高新子公司百克生物的带状疱疹减毒活疫苗上市申请已获CDE受理。这是首个报产的国产带状疱疹减毒活疫苗。
带状疱疹是由潜伏在体内的水痘-带状疱疹病毒(Varicella zoster virus, VZV)再激活而引起的一种急性感染性皮肤疾病。截至目前,全球范围内共有两款带状疱疹疫苗上市,分别为默沙东的Zostavax和葛兰素史克的Shingrix。其中Shingrix于2019年在国内获批进口,用于 50 岁及以上成人带状疱疹的预防,价格约为1600元/支,共需接种2针。
数据来源:药智数据
两款重磅新药申报进口
沙芬酰胺片(safinamide)是一款帕金森病治疗新药,已于2017年获得美国FDA批准,成为十余年来首个在美国获批用于治疗帕金森病的新化学实体。该药由Newron Pharmaceuticals开发,由Zambon公司、Meiji Seika、卫材、Supernus Pharmaceuticals等公司负责商业化。沙芬酰胺作用方式独特,有望能避免多巴胺被MAO-B降解,从而缓解帕金森病患者在“关闭”期的运动能力下降。临床试验表明,沙芬酰胺能在短期内控制帕金森病患者的运动症状和运动并发症,并可将疗效维持2年。因此,2017年3月,FDA宣布批准沙芬酰胺片(商品名为Xadago)作为一种附加治疗药物,用于目前正在服用左旋多巴/卡比多巴并出现“关期”发作的帕金森病患者。
erenumab注射液是一款预防性偏头痛治疗药物,也是国内首款申报上市的抗 CGRPR 单抗。公开资料显示,Erenumab是一种人源化单克隆抗体,能够有效并特异地结合人体内的CGRP受体,从而缓解偏头痛。Erenumab最早由安进开发,2015 年 8 月,诺华与安进达成合作,共同开发阿尔茨海默病和偏头痛领域新药,其中就包括了 Erenumab;2017 年 4 月,两家公司扩大了针对 Erenumab 的全球合作,共同在美国开发 Erenumab,安进保留在日本的独家商业化权利,而诺华则在世界其他地区商业化该产品。2018 年 5 月,Erenumab 获美国 FDA 批准用于成人偏头痛的预防性治疗,成为针对 CGRP 通路首款获批上市新药,商品名为 Aimovig。迄今为止,该药已经在日本、欧盟、英国、加拿大、澳大利亚等七十余个国家获得批准。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床