发布时间:2021-08-30
看点:
1、24个新药申请获得临床试验默认许可,包括14个国产1类新药
2、CDE新受理23个新药(29个受理号)的临床试验申请
3、正大天晴慢性乙肝新药获批临床!
4、多款双抗获批临床!
药智数据显示,本期(8月20日至8月27日)有24个新药获批临床(31个受理号);涉及17款国产新药,7款进口新药,更多动态如下:
新药临床申请·新获批
本期,24个新药(31个受理号)获得临床试验默示许可,包括14个国产1类新药。获批临床的创新药包括ADC、BET抑制剂、SINE、PD-1/CTLA-4双抗、CD3/EGFR双抗、HER2/CD3双抗、PD-L1/TGF-βRII双功能融合蛋白、LAG-3单抗、CD47单抗、EGFR单抗、PD-1单抗、GLP-1 受体激动剂等,适应症包括肿瘤、CIDP、重症肌无力、肾病、慢性乙肝、糖尿病、帕金森病、疼痛等。
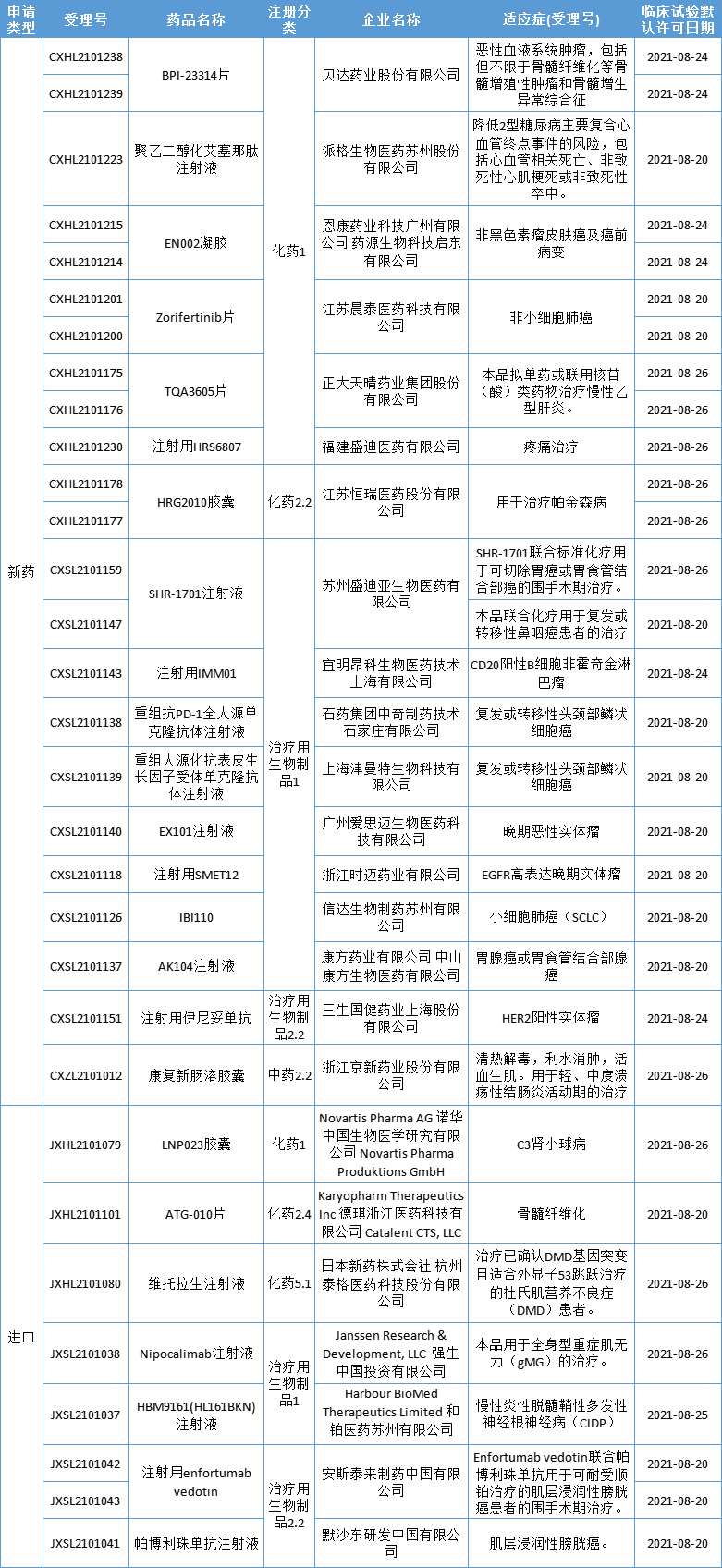
数据来源:药智数据
1.BPI-23314片
BPI-23314是一个由贝达药业自主研发的一款新分子实体化合物,是一种新型强效、选择性的溴结构域和末端外结构域(Bromodomain and extra-terminal domain, BET)蛋白家族的口服小分子抑制剂,具有全新的降解靶点蛋白的作用机制,拟用于血液瘤、乳腺癌以及肺癌等肿瘤的治疗。临床前数据显示,BPI-23314抑制BET相关多种癌症基因表达及降解靶蛋白BRD4,还能有效抑制炎症相关信号通路活化和炎症因子的表达,在血液瘤方面的早期临床试验结果显示其安全性和PK性质良好。
BPI-23314已获批开展多项临床试验,包括单药用于恶性血液系统肿瘤(急性髓系白血病、非霍奇金淋巴瘤和多发性骨髓瘤)、晚期恶性实体瘤和本次获批的恶性血液系统肿瘤,包括但不限于骨髓纤维化等骨髓增殖性肿瘤和骨髓增生异常综合征。
2.SHR-1701注射液
SHR-1701是恒瑞自主研发并具有知识产权的抗PD-L1/TGF-βRII双功能融合蛋白,目前正在中国开展多项临床,适应症涉及恶性肿瘤、胰腺癌和非小细胞肺癌等。其中,针对晚期结直肠癌、晚期或转移性胃癌或胃食管结合部癌两项适应症的临床推进最快,处于III期临床阶段。SHR-1701在澳洲单药治疗实体瘤的临床也在同步进行中。
本次获批2项临床试验:(1)SHR-1701联合标准化疗用于可切除胃癌或胃食管结合部癌的围手术期治疗;(2)联合化疗用于复发或转移性鼻咽癌患者的治疗。
3.注射用HRS6807
恒瑞医药子公司福建盛迪医药1类新药注射用HRS6807获NMPA批准开展临床试验,适应症为:疼痛治疗。
4.HRG2010胶囊
恒瑞医药2.2类新药HRG2010胶囊获NMPA批准开展临床试验,拟用于治疗帕金森病。
5.聚乙二醇化艾塞那肽注射液
派格生物 1 类新药物—长效 GLP-1 受体激动剂 PB-119「聚乙二醇艾塞那肽注射液」新适应症获批临床,拟用于降低2型糖尿病主要复合心血管终点事件的风险,包括心血管相关死亡、非致死性心肌梗死或非致死性卒中。
PB-119 是在艾塞那肽基础上进行聚乙二醇化修饰,延长药物半衰期、最终实现一周一次皮下注射给药即可平稳有效控制血糖水平。派格拥有该化合物的中国专利和国际专利,以及相关专利的所有法律权利,并在中国和美国同步开展临床研究。
6.EN002凝胶
EN002是恩康药业首创的全新靶标DNA复制起始蛋白(DRIPs)抑制剂,是公司首个基于源头创新自主开发的新一代抗肿瘤药物。本次获批临床适应症是非黑色素瘤皮肤癌及癌前病变。
7.Zorifertinib片
晨泰医药申报的1类新药zorifertinib片获得临床试验默示许可,拟开发用于治疗非小细胞肺癌(NSCLC)。Zorifertinib(AZD-3759 )最初由阿斯利康研发,后由获得许可的晨泰医药研发。资料显示,zorifertinib是一款新一代EGFR-TKI药物,具有高达100%的血脑屏障透过率,目前正在EGFR突变阳性NSCLC伴CNS转移患者中开展2/3期临床研究。
8.TQA3605片
正大天晴TQA3605片的临床试验申请获得药监局批准,拟单药或联用核苷(酸)类药物治疗慢性乙型肝炎。中国是肝病大国,从上个世纪80年代开始,正大天晴开始专注肝病药物的研发,相继上市了一类新药天晴甘美、抗病毒药润众、晴众等10多个肝病领域的产品。目前还有多个乙肝创新药处于临床研究阶段。
9.注射用IMM01
注射用IMM01是基于宜明昂科“mAb-Trap”技术平台研发的、具有自主知识产权的新一代免疫检查点抑制剂,针对免疫调节靶点CD47,通过激活巨噬细胞对肿瘤细胞的吞噬作用,并将吞噬处理的肿瘤抗原递呈给 T 细胞,从而发挥强大的肿瘤免疫治疗效应。IMM01解决了CD47靶点药物研发核心痛点,目前已分别在中国、日本和美国获批发明专利。本次获批临床适应症为CD20阳性B细胞非霍奇金淋巴瘤。
10.EX101注射液
EX101是一款靶向HER2/CD3双靶点的双抗,也是爱思迈第二款进入临床阶段的CD3靶点双抗,本次获批适应症为晚期恶性实体瘤。上个月,爱思迈的另一款双抗EX103(靶向CD20/CD3)获批临床,目前正在开展针对CD20阳性的非霍奇金淋巴瘤的I期临床研究。
11.重组抗PD-1全人源单克隆抗体注射液
石药集团子公司石药集团中奇制药技术石家庄有限公司PD-1新适应症获批临床,用于治疗复发或转移性头颈部鳞状细胞癌。此前,石药集团PD-1还获批了复发或转移性鼻咽癌和卵巢癌临床试验。
12.重组人源化抗表皮生长因子受体单克隆抗体注射液
石药集团附属公司上海津曼特EGFR单抗获批临床,适应症为复发或转移性头颈部鳞状细胞癌。EGFR蛋白是体内细胞表面的一种蛋白质,由EGFR基因表达产生,俗称“表皮生长因子受体”,与表皮细胞生长息息相关。当EFGR基因发生突变时,它会疯狂表达EGFR蛋白,导致细胞膜表面表皮生长因子受体过多,加速促进细胞异常生长和分裂,最终导致肿瘤发生。EGFR单抗通过抑制EGFR蛋白的表达,达到治疗效果。
13.注射用SMET12
时迈药业CD3/EGFR双抗「注射用SMET12」获批临床,适应症为EGFR高表达晚期实体瘤。SMET12一方面靶向EGFR,可以抑制EGFR蛋白的表达;另一方面靶向CD3抗原,可将T细胞集中至肿瘤细胞处,激活T细胞对肿瘤细胞进行免疫杀伤,实现双重抗肿瘤作用。
14.IBI110
信达生物IBI110治疗小细胞肺癌(SCLC)获批开展临床试验。IBI110是一种靶向于淋巴细胞活化基因3蛋白(LAG-3,也称作CD223)的单克隆抗体。LAG-3中文名称为淋巴细胞活化基因-3,是免疫球蛋白超家族的一员,与CD4密切相关,能够选择性的表达在活化的T细胞、NK细胞等免疫细胞表面,与肿瘤、结核等多种疾病相关。全球范围内尚未有该靶点药物上市,但已有不少在研项目。
15.AK104注射液
AK104注射液是康方生物利用其Tetrabody双抗平台、自主研发的首款双抗产品,也是全球首个进入临床试验的PD-1/CTLA-4双特异抗体。AK104注射液已国内获批开展多项临床试验,本次获批适应症为胃腺癌或胃食管结合部腺癌。8月23日,国家药品监督管理局(NMPA)药品审评中心(CDE)已经同意Cadonilimab(AK104注射液)治疗复发或转移性宫颈癌的新药上市申请,并给予优先审评资格,有望成为国内首款国产双抗产品。
16.注射用伊尼妥单抗
三生国健HER2单抗赛普汀?(伊尼妥单抗)与宜明昂科CD47融合蛋白IMM01的组合方案,获国家药监局临床试验默示许可,即将开展一项用于治疗HER2+实体瘤患者的Ib/II期临床。伊尼妥单抗是罗氏曲妥珠单抗的生物类似物,是首个国产HER2单抗。2020年6月,伊尼妥单抗获得NMPA批准上市,用于联合化疗治疗HER2阳性转移性乳腺癌;年底通过谈判被纳入国家医保目录。三生国健正在开展多项临床,评估与其他创新药物联用,拟扩展伊尼妥单抗的临床适应症。
17.LNP023胶囊
LNP023是诺华(Novartis)开发的一款口服,特异性“first-in-class”补体因子B抑制剂,可通过靶向补体替代信号通路,阻断血管内和血管间溶血。目前,这款创新疗法在临床试验中用于治疗阵发性睡眠性血红蛋白尿症(PNH)、特发性膜性肾病、IgA肾病、原发性IgA肾病,以及本次获批的C3肾小球病。
18.ATG-010片
德琪医药塞利尼索(XPOVIO?)治疗骨髓纤维化(MF)的II期临床研究获得国家药品监督管理局批准。塞利尼索是同类首款且唯一一款口服型选择性核输出抑制剂(SINE)化合物,由Karyopharm Therapeutics Inc.研发。德琪医药在包括大中华区、韩国、澳大利亚、新西兰和东盟国家的多个亚太市场获得了塞利尼索的独家开发和商业化权利,并获得了韩国新药上市申请的优先获批。此前,塞利尼索已先后于美国、以色列、欧盟以及韩国获批,用于难治复发性多发性骨髓瘤(MM)和弥漫性大B细胞淋巴瘤(DLBCL)的治疗;后续还将于2021年第四季度至2022年第一季度在多个亚太市场获批上市。
19.Nipocalimab注射液
强生公司旗下杨森(Janssen)公司申报的1类新药nipocalimab注射液获批一项临床试验,拟用于全身型重症肌无力(gMG)的治疗。Nipocalimab是Momenta公司开发的一款与FcRn结合的IgG1抗体。2020年8月,强生公司以约65亿美元收购Momenta公司,获得了包括后者主要在研产品nipocalimab在内的研发管线项目。
20.HBM9161(HL161BKN)注射液
巴托利单抗(HBM9161)是由HanAll Biopharma开发的一款靶向新生儿Fc受体(FcRn)的全人源单克隆抗体,和铂医药于2018年获得了该药在大中华区(包括中国大陆、香港,澳门和台湾地区)进行开发、生产和商业化的权利。此前,巴托利单抗已在中国获批开展多项临床研究,本次获批新适应症:慢性炎性脱髓鞘性多发性神经根神经病(CIDP)。
21.注射用enfortumab vedotin
安斯泰来注射用enfortumab vedotin获批临床,适应症为联合帕博利珠单抗用于可耐受顺铂治疗的肌层浸润性膀胱癌患者的围手术期治疗。enfortumab vedotin是一款抗体偶联药物(ADC),可通过enfortumab精准瞄准癌症细胞,通过MMAE导致癌症细胞周期阻滞和凋亡。
22.帕博利珠单抗注射液
默沙东PD-1单抗帕博利珠单抗注射液新适应症获批临床,拟用于治疗肌层浸润性膀胱癌。
新药临床申请·新受理
本期,CDE新受理23新药(29个受理号)临床申请。其中,17个品种(23个受理号)为国产新药,6个品种(6个受理号)为进口新药,更多动态如下:
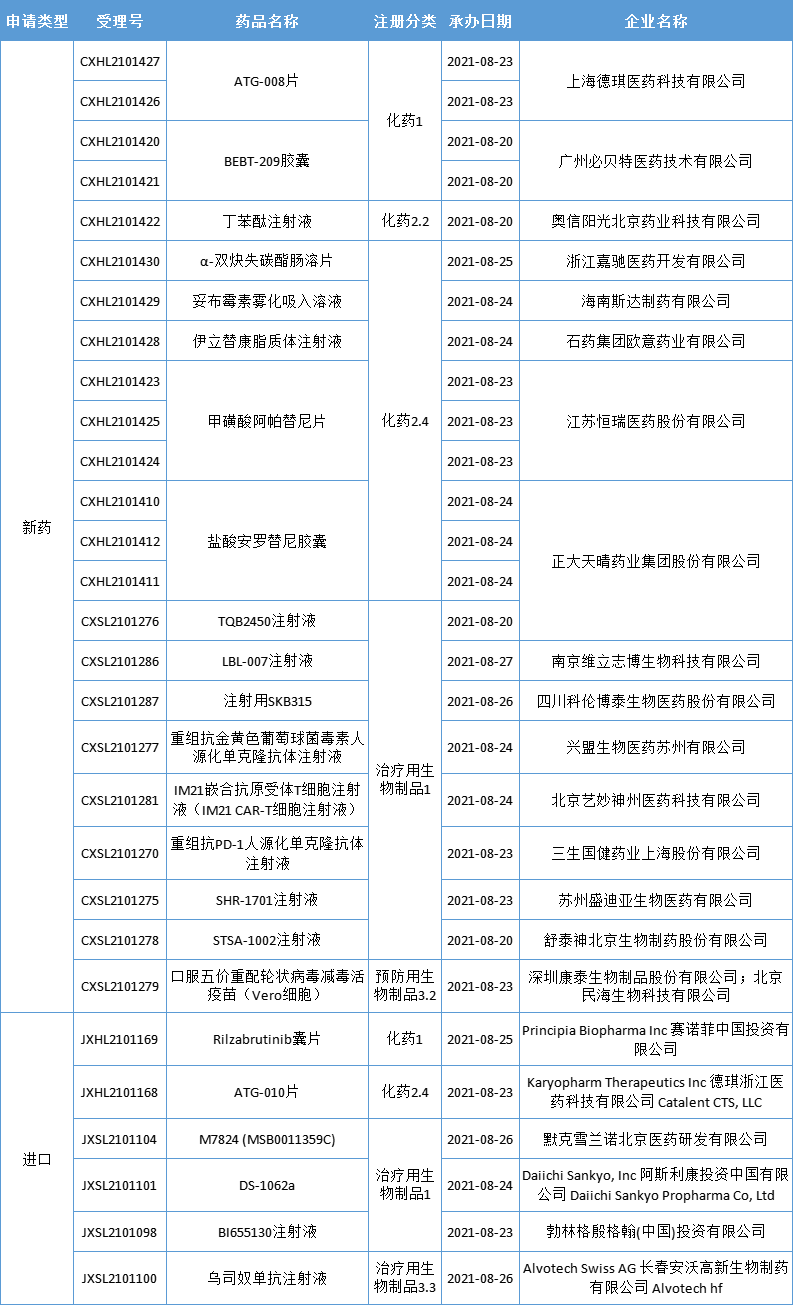
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床

联系我们
服务热线:0755-66853366
市场部:136 7004 6396 (微信同号)
邮箱:sales@chem-strong.com
办公地址:深圳市龙岗区碧新路2055号佳业广场1201室
*本公司所有产品仅供研发使用,不能用于人体或动物临床